它在全球范围每年造成超过25万人死亡,更令诸多名人纷纷中招,包括“股神”巴菲特、 传媒大亨默多克、美国前总统里根、“南非国父”曼德拉、美国前国务卿鲍威尔、 委内瑞拉前总统查韦斯、新加坡总理李显龙,还有知名台湾作家李敖等 [1]。
前列腺癌(Prostatic Carcinoma, PCa)是男性泌尿生殖系统中最常见的恶性肿瘤之一。 随着全球人口老龄化的加剧,前列腺癌的发病率呈现出显著的上升趋势,对男性的健康 构成了严重威胁。
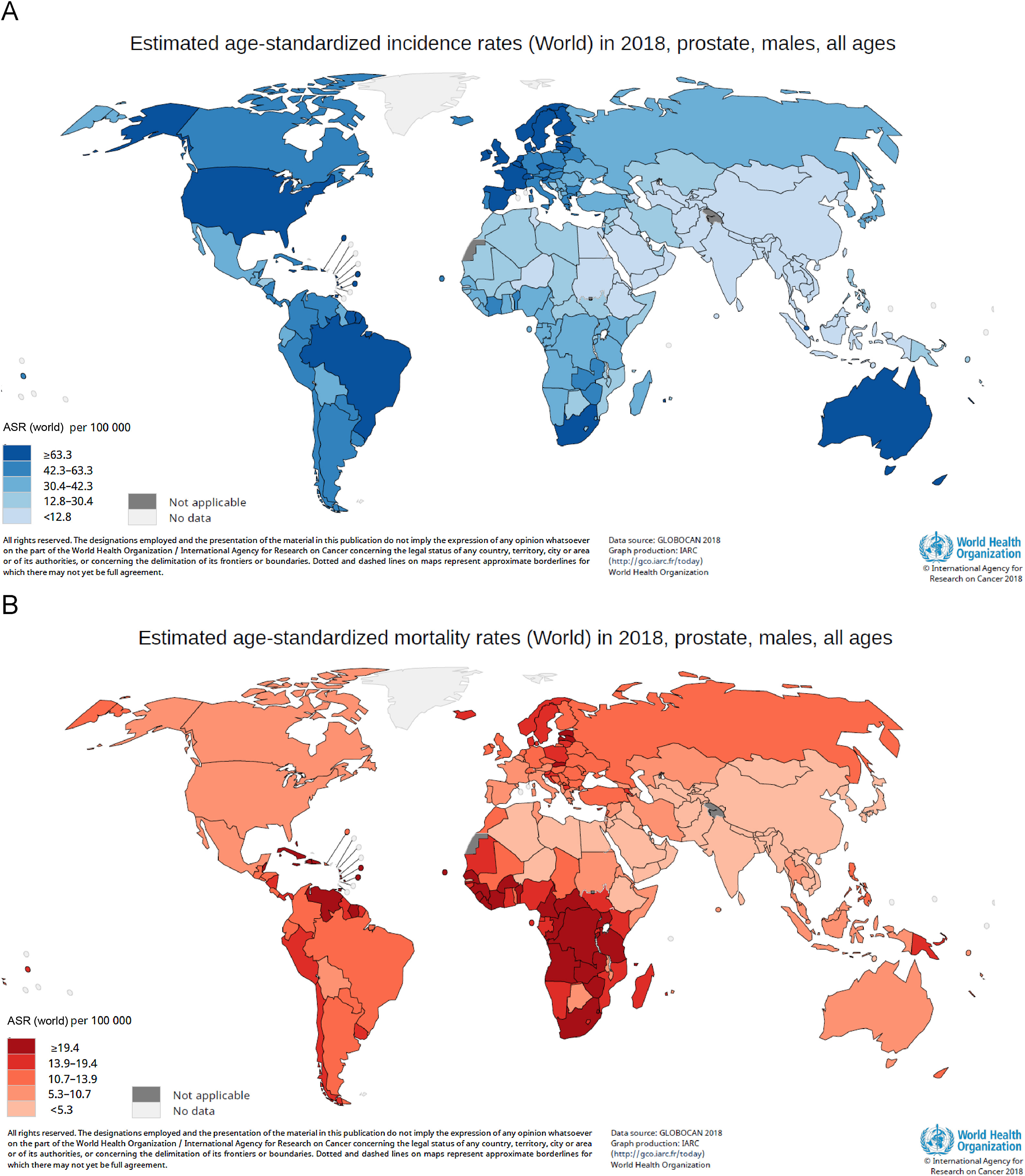
图1.(A)年龄标准化前列腺癌发病率的国际差异。(B)年龄标准化前列腺癌死亡率的国际差异。 ASR=年龄标准化率;IARC=国际癌症研究机构。资料来源:GLOBOCAN 2018 [2]。
前列腺癌是全球第二大最常诊断的癌症,也是男性癌症死亡的第六大原因, 2018年估计有127.6万例新发癌症病例和35.9万例死亡。仅由于人口增长和老龄化, 到2040年,全球前列腺癌负担预计将增加到近230万新病例和74万死亡病例。年龄较大, 黑人种族和家族病史是前列腺癌的唯一确定的危险因素。有证据表明,身体肥胖、成人身高、 乳制品、高钙饮食、低血浆硒和α-生育酚浓度会增加患前列腺癌的风险 [2]。
中国前列腺癌的发病率虽低于欧美国家, 但近年来呈现出快速增长的趋势。2022年, 中国前列腺癌的新发病例数为13.42万人, 死亡病例数为4.75万人 [3]。相较于10年前, 前列腺癌的发病和死亡率都有显著增加,这可能与人口老龄化、 生活方式的改变以及肿瘤检测的普及有关。
前列腺癌(Prostate Cancer)是发生在前列腺(男性生殖系统的一部分)的恶性肿瘤,起源于前列腺腺体或导管的上皮细胞。
前列腺位置:位于膀胱下方,环绕尿道,分泌前列腺液参与精液组成。
流行病学:全球男性最常见的恶性肿瘤之一,好发于50岁以上中老年男性,早期常无症状,可通过PSA(前列腺特异性抗原)检测、直肠指检及影像学发现。
特征:多数生长缓慢(惰性),但部分类型侵袭性强,易转移至骨骼、淋巴结等部位。
1、组织学分类(病理类型)
根据癌细胞起源和形态特征划分:
腺癌(Adenocarcinoma):占95%以上,起源于前列腺腺泡或导管上皮细胞。
腺泡腺癌:最常见亚型,形成腺体结构。
导管腺癌:起源于前列腺导管,侵袭性较强。
其他罕见类型(<5%):
神经内分泌癌:高度恶性,预后差。
移行细胞癌:起源于尿道周围组织,类似膀胱癌。
鳞状细胞癌:极罕见,对激素治疗不敏感。
肉瘤:来源于间叶组织(如平滑肌肉瘤)。
2、临床分期(TNM分期系统)
根据肿瘤侵犯范围、淋巴结转移及远处转移情况划分(AJCC第8版)。
【T (原发肿瘤)】
T1:临床隐匿,通过活检或PSA升高发现(如T1c)。
T2:局限于前列腺内,分T2a-T2c(累及单侧或双侧)。
T3:突破前列腺包膜(T3a)或侵犯精囊(T3b)。
T4:侵犯膀胱、直肠等邻近器官。
【N (淋巴结转移)】
N0:无淋巴结转移; N1:区域淋巴结转移。
【M (远处转移)】
M0:无远处转移; M1:转移至骨骼(M1b); 其他器官(M1c)等。
3、病理分级 (恶性程度评估)
Gleason评分:基于显微镜下肿瘤结构异型性,评分范围2-10分。
评分规则:主要生长模式(占比最大)+次要生长模式(占比次之),各评1-5分,两者相加为总分。
分级组(Grade Group):
Grade Group 1:Gleason 6分(低危)。
Grade Group 2:Gleason 3+4=7分(中危)。
Grade Group 3:Gleason 4+3=7分(中高危)。
Grade Group 4:Gleason 8分(高危)。
Grade Group 5:Gleason 9-10分(极高危)。
4、分子分型
根据基因突变和分子特征划分(研究进展中,指导靶向治疗):
激素敏感型:依赖雄激素信号通路(如AR基因突变)。
去势抵抗型(CRPC):在雄激素剥夺治疗(ADT)后仍进展。
特定基因变异:如BRCA1/2、PTEN缺失、TP53突变等,可能影响预后和治疗选择。
5、临床危险分层(治疗决策参考)
综合PSA水平、Gleason评分及TNM分期分为:
低危:T1-T2a, Gleason≤6, PSA<10 ng/mL。
中危:T2b 或 Gleason7 或 PSA 10-20 ng/mL。
高危:T3-T4 或 Gleason≥8 或 PSA>20 ng/mL。
极高危:局部晚期或淋巴结转移。
前列腺疾病主要包括前列腺炎、前列腺增生和前列腺癌等,不同疾病有不同的症状和体征。
1、前列腺炎
【症状】
尿路症状:尿频、尿急、尿痛、排尿困难、尿后滴沥、夜尿增多等。
疼痛症状:会阴部、下腹部、腰骶部、腹股沟区等部位的疼痛或不适,可能放射至大腿内侧。
性功能障碍:性欲减退、早泄、射精痛、勃起减弱及阳痿等。
全身症状:乏力、虚弱、厌食、恶心、呕吐、高热、寒战等。
【体征】
前列腺肿大:直肠指诊可触及肿大的前列腺,质地较硬,表面不光滑。
尿道口红肿:尿道口可能出现红肿,伴有脓性或粘液性分泌物。
2、前列腺增生
【症状】
尿路症状:尿频、尿急、排尿困难、尿线变细、尿流中断、尿后滴沥等。
尿潴留:当增生导致残余尿量增多时,可能引发急性尿潴留,表现为下腹部胀痛难忍,无法自主排尿。
血尿:增生的前列腺黏膜血管充血,可能在排尿时出现血尿。
【体征】
前列腺增大:直肠指诊可触及增大的前列腺,表面光滑,质地韧。
肾积水:严重时可导致肾积水,腹部检查可触及肿大的肾脏。
3、前列腺癌
【症状】
早期症状不明显:早期前列腺癌可能无明显症状,或仅有轻微的尿路刺激症状。
晚期症状:随着肿瘤的进展,可能出现尿频、尿急、尿痛、排尿困难、血尿、骨痛等症状。
【体征】
前列腺硬结:直肠指诊可触及前列腺内的硬结,质地坚硬,表面不光滑。
淋巴结肿大:晚期可能出现盆腔淋巴结肿大,触及肿大的淋巴结。
前列腺疾病若未及时治疗,可能引发多种并发症。
1. 前列腺炎的并发症
性功能障碍:包括勃起功能障碍、早泄、射精痛等,影响患者的性生活质量。
生殖功能障碍:前列腺炎可能导致精子活力下降、死精等,进而引起男性不育。
心理精神障碍:长期的疼痛和不适可能导致患者出现焦虑、抑郁等心理问题。
尿路感染:炎症可能蔓延至尿路,引发膀胱炎、肾盂肾炎等。
前列腺结石:炎症导致前列腺液中钙盐沉积,形成结石。
2. 前列腺增生的并发症
尿潴留:增生导致尿道梗阻,可能引发急性尿潴留,需要紧急处理。
膀胱结石:尿路梗阻易引发感染,形成膀胱结石。
血尿:增生的前列腺黏膜血管充血,可能在排尿时出现血尿。
肾功能损害:严重时可导致肾积水、肾功能不全,甚至出现尿毒症。
痔疮、脱肛:排尿困难增加腹压,容易引发痔疮和脱肛。
3. 前列腺癌的并发症
骨转移:前列腺癌容易发生骨转移,导致骨痛、病理性骨折等。
尿路梗阻:肿瘤增大可能压迫尿道,导致排尿困难、尿潴留等。
感染:肿瘤破坏组织,容易引发感染,如尿路感染、败血症等。
肾功能损害:肿瘤侵犯肾盂、肾盏,导致肾积水,影响肾功能。
前列腺癌的实验室检查、影像学技术及病理活检,目的是早期发现、明确分期并制定治疗方案。
【PSA检测】
总PSA (tPSA):基础筛查指标,但受前列腺炎、良性增生(BPH)等因素干扰。
游离PSA (fPSA):计算fPSA/tPSA比值,比值低(如<10%)提示癌变风险高。
PSA密度 (PSAD):PSA值/前列腺体积(通过超声或MRI计算),帮助区分癌与良性增生。
PSA速率 (PSAV):监测PSA随时间升高的速度(如年增长>0.75 ng/mL需警惕)。
【其他生物标志物】
4Kscore检测:联合4种蛋白标志物(tPSA、fPSA、hK2、KLK2),预测高级别癌风险。
前列腺健康指数 (PHI):结合PSA相关指标,提高诊断特异性。
尿液检测:如PCA3基因、TMPRSS2-ERG融合基因 (辅助诊断)。
【超声检查】
经直肠超声 (TRUS):评估前列腺体积、结节位置,引导穿刺活检。
多参数超声 (CEUS):增强造影观察血流,辅助定位可疑病灶。
【多参数磁共振成像 (mpMRI)】
作用:检测临床显著癌灶(敏感性>90%),评估肿瘤范围及包膜侵犯。
PI-RADS评分:基于MRI特征对病灶恶性程度分级(1-5分,≥4分需活检)。
【全身影像评估(分期)】
骨扫描(骨显像):检测骨转移(注射放射性核素后显影)。
CT或PET-CT:评估淋巴结及远处转移(如PSMA-PET对微小转移灶敏感)。
全身MRI:无辐射,适用于骨转移及软组织评估。
【前列腺穿刺活检】
适用情况:PSA升高或影像学异常者。
【方法】
经直肠或会阴穿刺:在超声或MRI融合引导下,取12-14针组织(系统活检)。
靶向活检:针对MRI提示的可疑病灶精准取样。
【病理报告内容】
癌组织Gleason评分(或Grade Group)。
癌占比、神经侵犯、手术切缘状态(术后标本)。
【液体活检(新兴技术)】
循环肿瘤细胞(CTC)或循环肿瘤DNA(ctDNA):监测转移或复发风险。
外泌体检测:分析前列腺癌特异性标志物 (如ExoDx Prostate测试)。
【TNM分期系统 (AJCC第8版)】
结合原发肿瘤(T)、淋巴结(N)、远处转移(M)及Gleason评分、PSA水平。
【危险分层(指导治疗)】
低危: T1-T2a,Gleason≤6,PSA<10 ng/mL。
中危: T2b 或 Gleason7 或 PSA 10-20 ng/mL。
高危: T3-T4 或 Gleason≥8 或 PSA>20 ng/mL。
前列腺癌的病因尚未完全明确,但大量研究表明其发生是遗传因素、环境因素、激素水平及生活方式等多因素共同作用的结果。
1、遗传因素
【家族史与遗传易感性】
一级亲属患病风险:家族中有前列腺癌患者的男性,患病风险增加2~3倍;若家族中有早发(<55岁)病例,风险更高。
【遗传性基因突变】
DNA修复基因:BRCA1/2、ATM等同源重组修复(HRR)基因突变显著增加风险(BRCA2突变者风险升高5~8倍)。
HOXB13基因:G84E突变与家族性前列腺癌密切相关。
其他基因:RNASEL、MSR1等基因变异可能参与炎症相关癌变。
2、激素水平异常
【雄激素信号通路】
雄激素(睾酮)水平:雄激素通过激活雄激素受体(AR)促进前列腺细胞增殖,长期高水平暴露可能增加癌变风险。
5α-还原酶活性:该酶将睾酮转化为双氢睾酮(DHT),活性过高可能与前列腺增生及癌变相关(如使用5α-还原酶抑制剂可降低部分风险)。
雌激素作用:老年男性雌激素/雄激素比例失衡可能通过炎症或表观遗传机制促进癌变。
3、年龄与种族差异
【年龄】
发病率随年龄增长显著上升,约75%病例确诊于65岁以上。
衰老伴随的基因组不稳定性(如端粒缩短、氧化损伤累积)是重要诱因。
【种族差异】
非裔男性发病率最高(比白人高60%),亚洲人群发病率较低,可能与遗传背景、雄激素代谢差异及维生素D水平有关。
4、环境与生活方式
高脂饮食:饱和脂肪摄入过多可能通过氧化应激和炎症促进癌变。
红肉与加工肉类:高温烹饪产生的杂环胺(HCAs)和多环芳烃(PAHs)具有致癌性。
乳制品:高钙摄入可能抑制维生素D活性,增加风险(争议性)。
植物性饮食保护作用:番茄(富含番茄红素)、十字花科蔬菜(含异硫氰酸酯)可降低风险。
肥胖与代谢综合征:肥胖导致脂肪组织释放炎症因子(如IL-6、TNF-α)及胰岛素抵抗,激活PI3K/AKT/mTOR通路促进肿瘤生长。
缺乏运动:久坐生活方式与前列腺癌进展风险相关,运动可能通过调节激素水平和免疫功能发挥保护作用。
5、炎症与感染
慢性前列腺炎:长期炎症导致活性氧(ROS)和活性氮(RNS)累积,引发DNA损伤和基因组不稳定。炎症微环境中巨噬细胞分泌的细胞因子(如TGF-β)促进上皮-间质转化(EMT),增强侵袭性。
性传播感染:衣原体、淋球菌等感染可能与慢性炎症相关,但证据尚不充分。
6、其他潜在因素
杀虫剂与重金属: 有机磷农药、镉等可能干扰激素代谢或诱导DNA损伤。
双酚A(BPA): 塑料制品中的环境雌激素可能通过表观遗传修饰 (如DNA甲基化异常)促进癌变。
电离辐射:长期暴露可能增加风险,但证据有限。
前列腺癌的分子生物学致病机制是一个多因素、多阶段的动态过程,涉及基因突变、表观遗传失调、激素信号通路异常、肿瘤微环境重塑及代谢重编程等复杂调控网络。其分子异质性显著,尤其从激素敏感性前列腺癌(HSPC)向去势抵抗性前列腺癌(CRPC)和神经内分泌分化(NEPC)的演变过程中,驱动机制发生根本性转变。
1、关键基因突变与分子分型
前列腺癌的基因组特征高度异质,关键驱动基因突变和分子亚型决定了疾病进展和治疗反应。
雄激素受体(AR)通路异常:
AR扩增/突变:CRPC中AR基因扩增(约50%)或点突变(如T878A、L702H)导致对低水平雄激素的超敏或广谱配体激活。
AR剪接变异体(如AR-V7):缺乏配体结合域,导致激素治疗耐药。
PTEN缺失与PI3K/AKT通路激活:PTEN缺失(约40%病例)导致PI3K/AKT/mTOR通路持续激活,促进细胞存活和代谢重编程。
TP53与RB1共缺失:TP53突变(>50% mCRPC)和RB1缺失(NEPC中>60%)导致基因组不稳定性及神经内分泌分化。
DNA修复基因缺陷(HRR):BRCA2、ATM等同源重组修复基因突变(约20% mCRPC)增加对PARP抑制剂的敏感性。
其他驱动基因:SPOP突变(10-15%原发性癌)导致BET蛋白降解异常;TMPRSS2-ERG融合(约50%)激活ETS转录因子家族。
2、雄激素信号通路的核心作用
经典AR信号:雄激素结合AR后入核调控PSA、KLK2等靶基因,促进细胞增殖。
非经典AR信号:
配体非依赖性激活(如IL-6、STAT3通路交叉对话)。
AR与糖皮质激素受体(GR)的补偿性激活(恩扎鲁胺耐药机制)。
AR与表观遗传互作:AR招募组蛋白乙酰转移酶(如p300)重塑染色质结构,增强致癌基因转录。
3、表观遗传学调控异常
DNA甲基化:GSTP1启动子高甲基化(>90%前列腺癌)导致解毒功能丧失;抑癌基因CDKN2A甲基化沉默。
组蛋白修饰:EZH2过表达(与NEPC相关)通过H3K27me3修饰抑制分化基因。
非编码RNA:
miRNA:miR-21促进转移(抑制PDCD4); miR-34a缺失导致AR信号增强。
lncRNA:PCAT1通过抑制BRCA2增强基因组不稳定性; SCHLAP1干扰SWI/SNF复合体功能。
4、肿瘤微环境(TME)与免疫逃逸
免疫抑制性细胞:肿瘤相关巨噬细胞(TAM-M2型)分泌IL-10、TGF-β,抑制CD8+T细胞活性。髓源性抑制细胞(MDSC)通过ARG1消耗微环境精氨酸,阻碍T细胞功能。
PD-1/PD-L1轴:前列腺癌普遍低免疫原性,但MSI-H或CDK12双等位缺失亚型可能对免疫检查点抑制剂敏感。
成纤维细胞与ECM重塑:癌症相关成纤维细胞(CAF)分泌CXCL12促进肿瘤生长和化疗抵抗。
5、代谢重编程与氧化应激
脂代谢异常:脂肪酸合成酶(FASN)过表达提供膜合成原料,并生成脂信号分子(如棕榈酸酯)激活AR。胆固醇摄取增加(通过SR-B1受体)支持细胞膜和类固醇激素合成(CRPC中“类固醇劫持”)。
谷氨酰胺依赖:谷氨酰胺酶(GLS1)上调维持TCA循环,靶向药物(如CB-839)在临床试验中。
氧化应激调控:NRF2通路激活增强抗氧化防御,与放疗抵抗相关。
前列腺癌的治疗需根据患者的年龄、肿瘤分期、分级、PSA水平、全身状况及个人意愿,制定个体化方案。西医治疗以手术、放疗、内分泌治疗为核心,结合化疗、靶向治疗、免疫治疗等,旨在根除病灶、控制进展并提高生存质量。
1. 主动监测(Active Surveillance)
适用人群:低危(Grade Group 1)、预期寿命<10年的老年患者。
方法:定期PSA检测、直肠指检(DRE)和重复穿刺活检,避免过度治疗。
转治疗指征:PSA快速上升、活检升级(如Gleason评分升高)或出现症状。
2. 根治性前列腺切除术(Radical Prostatectomy)
【术式】
开放手术:经耻骨后或会阴路径。
腹腔镜/机器人辅助手术:创伤小、恢复快,保留性神经更精准(达芬奇机器人系统)。
适应症:中高危局限性癌(T1-T2)、预期寿命>10年且无严重合并症者。
并发症:尿失禁(早期发生率10-20%,1年后多恢复)、勃起功能障碍(保留神经者风险降低)。
3. 放射治疗(Radiotherapy)
外照射放疗(EBRT):
调强放疗(IMRT)/立体定向放疗(SBRT):精准靶向肿瘤,减少直肠和膀胱损伤。
剂量:70-80 Gy分次照射,高危患者需联合盆腔淋巴结照射。
近距离放疗(Brachytherapy):
永久性粒子植入(碘-125或钯-103):适用于低中危、前列腺体积<50 mL者。
联合治疗:高危患者术后放疗(挽救性放疗)或术前新辅助放疗。
1. 联合治疗(手术/放疗 + 内分泌治疗)
新辅助内分泌治疗(ADT):术前或放疗前使用,缩小肿瘤体积 (降低切缘阳性率)。
辅助内分泌治疗:术后或放疗后持续ADT 2-3年,降低复发风险。
2. 扩大淋巴结清扫
针对影像学可疑淋巴结转移者,明确分期并可能延长生存。
1. 内分泌治疗(雄激素剥夺治疗,ADT)
一线方案:
GnRH激动剂 (如亮丙瑞林、戈舍瑞林):抑制睾酮至去势水平(<50 ng/dL)。
GnRH拮抗剂 (如地加瑞克):快速降睾酮,无“反跳现象”(Flare-up)。
联合抗雄治疗 (CAB):ADT + 抗雄药物(如比卡鲁胺),阻断残留雄激素信号。
副作用:潮热、骨质疏松、代谢综合征、认知功能下降。
2. 新型内分泌治疗(针对去势抵抗性前列腺癌,CRPC)
阿比特龙(Abiraterone): 抑制CYP17酶,阻断肾上腺及肿瘤内雄激素合成(需联用泼尼松)。
恩扎卢胺 (Enzalutamide): 雄激素受体(AR)拮抗剂,抑制核转位及DNA结合。
达洛鲁胺 (Darolutamide): 新一代AR拮抗剂,中枢穿透性低(减少癫痫风险)。
3. 化疗
多西他赛(Docetaxel):一线化疗药物,延长生存期(联合泼尼松)。
卡巴他赛(Cabazitaxel):多西他赛耐药后的二线选择。
4. 靶向治疗
PARP抑制剂(奥拉帕利、卢卡帕利):针对DNA修复缺陷(如BRCA1/2突变)患者。
PSMA靶向疗法:177Lu-PSMA-617(放射性配体疗法)精准杀伤PSMA阳性肿瘤细胞,用于晚期CRPC。
PSMA-CAR-T(临床试验中):免疫细胞疗法。
5. 免疫治疗
PD-1/PD-L1抑制剂:仅限微卫星不稳定(MSI-H)或高肿瘤突变负荷(TMB-H)患者(约5%)。
Sipuleucel-T(树突状细胞疫苗):延长转移性CRPC生存期,但国内未上市。
6. 骨转移管理
双膦酸盐(如唑来膦酸)或地诺单抗(Denosumab):预防骨相关事件(骨折、脊髓压迫)。
镭-223(223Ra):发射α粒子,缓解骨痛并延长生存(仅限成骨性转移)。
1. 生化复发(PSA升高)
根治性治疗后复发:挽救性放疗(术后)或ADT(放疗后)。
远处复发:影像学评估转移部位,按转移性癌治疗。
2. 去势抵抗性前列腺癌(CRPC)
非转移性CRPC(nmCRPC):达洛鲁胺/恩扎卢胺/阿帕他胺,延缓转移。
转移性CRPC(mCRPC):序贯使用阿比特龙、多西他赛、镭-223、PARP抑制剂等。
激素治疗相关:
骨质疏松:补充钙、维生素D,定期骨密度监测。
代谢综合征:控制血糖、血脂,增加运动。
放疗相关:
放射性直肠炎:低渣饮食、局部激素灌肠。
膀胱炎:多饮水,α受体阻滞剂缓解排尿困难。
化疗相关:
骨髓抑制:G-CSF升白细胞,输血支持。
神经毒性:营养神经药物(如维生素B12)。
本病属于中医癃闭、淋证、腰痛等范畴,其主要病因病机为肾气亏损,阴阳失调, 湿热痰浊气血瘀滞所致。
【辨证用方】
前列腺癌的辨证,当分清虚实,初起湿热蕴结,以致膀胱气化失司者属实, 治宜清热利湿通淋,活血化瘀,佐以行气。病久脾肾两亏,膀胱气化无权者属虚, 治宜培补脾肾。虚实夹杂者,宜标本兼治。根据患者的不同临床表现,或参以止血, 或佐以泄浊等以达到扶正祛邪的目的。
1.湿热蕴结证
【主症】尿频、尿急、尿痛,排尿困难,小便短赤灼热,腰背酸痛,小腹胀满, 舌质红,苔黄腻,脉滑数。
【治法】清利湿热,通利小便。
【主方】八正散加减(潘敏求经验方)
【组成与用法】海金沙(布包)15g,瞿麦10g,滑石(布包)15g,山栀子15g, 车前子(布包)10g,萹蓄10g,炮穿山甲(先煎)12g,白茅根30g,石韦10g, 土茯苓30g,白花蛇舌草30g,莪术10g,夏枯草15g,甘草5g。水煎服。
【功能主治】清利湿热,通利小便。主治前列腺癌
【加减应用】兼心烦,口舌生疮廉烂者,改甘草为甘草梢5g; 加生地16g,竹叶10g;湿热久蕴下焦,致肾阴灼伤四干咽燥,潮热盗汗, 手足心热,舌尖红者,加知母、生地、牛膝。
2.瘀血凝滞证
【主症】小便点滴而下,或时而通畅,时而闭塞不通,疼痛,小腹胀满疼痛, 舌质紫黯,或有瘀点,脉涩或细数。
【治法】化瘀散结,通利下焦。
【主方】膈下逐瘀汤加减(《中华肿瘤治疗大成》)
【组成与用法】当归尾15g,赤芍15g,桃仁10g,红花10g,五灵脂(布包)10g, 乌药10g,王不留行10g,延胡索10g,炮山甲(先煎)10g,丹参10g,败酱草10g, 瞿麦10g,马鞭草10g,泽泻15g,石见穿30g。水煎服。
【功能主治】化瘀散结,清热解毒。主治前列腺癌。
【加减应用】病久体虚者,改当归尾为全当归,加黄白术、茯苓;小便一时不通, 胀闭难忍,加麝香(吞0.05g)。
3.肾气亏虚证
【主症】小便不通或点滴不爽,排出无力,双下肢浮肿,神建怯弱, 腰膝冷而疲软无力,面色苍白,畏寒肢冷,神气供弱,舌质黯,苔白, 脉沉细。
【治法】温阳益气,补肾利尿。
【主方】济生肾气丸加减(《中华肿瘤治疗大成》)
【组成与用法】肉桂6g,制附片(先煎)10g,熟地15g,丹皮10g,茯苓15g, 泽泻10g,山茱萸10g,牛膝15g,车前子(布包)15g,炮穿山甲(先煎)10g, 刺猬皮10g,夏枯草30g,龙葵15g。水煎服。
【功能主治】温补肾阳,化瘀散结。主治前列腺癌。
【加减应用】肾阴阳两虚者,加鹿角胶(烊化)、龟甲(先煎)、人参(蒸兑)、枸杞子。
4.气阴两虚证
【主症】尿流变细,排出无力或点滴不通,面色无华,贫血消瘦,倦怠乏力, 心悸怔忡,动则气促,头晕眼花,饮食减退,身疼腰痛,潮热盗汗,舌红, 苔少或无苔,脉细数。
【治法】益气健脾,养阴滋肾。
【主方】生脉散加味(《临床中医肿瘤学》)
【组成与用法】太子参15g,麦冬12g,五味子6g,制首乌12g,枸杞子12g, 生黄芪15g,炙鳖甲(先煎)9g,炙龟甲(先煎)9g,白英10g,蛇莓10g。水煎服。
【功能主治】益气养阴,解毒散结。主治前列腺癌。
【加减应用】眩晕耳鸣者,加杭菊、女贞子;伴津亏便者,加玄参、决明子、 肉苁蓉;血虚甚者,加熟地、阿胶。
5年相对生存率 (所有分期综合); 约97% (2013-2019年数据)。
10年生存率:约98% (局限性癌)、85% (局部进展期)、30%(转移性癌)。
1. 局限性前列腺癌(未突破包膜,无转移)
5年生存率:接近100%。
10年生存率:95%-99%。
治疗影响:根治性手术或放疗后,多数患者可长期无瘤生存。
2. 局部进展期(侵犯包膜或精囊,无远处转移)
5年生存率:约95%。
10年生存率:80%-90%。
治疗关键:需联合手术/放疗 + 内分泌治疗,降低复发风险。
3. 区域转移(淋巴结转移)
5年生存率:约70%。
治疗重点:长期内分泌治疗 + 化疗/靶向治疗。
4. 远处转移(骨、肺、肝等)
5年生存率: 约30%(近年靶向治疗和新型内分泌药物应用后有所提升)。
中位生存期:
初诊转移性癌: 3-5年(传统治疗); 新型疗法 (如PSMA靶向治疗)可延长至5-7年。
去势抵抗性前列腺癌(CRPC): 中位生存期1-2年,但个体差异大。
前列腺癌的预后受多种因素影响,总体而言,早期发现并接受规范治疗的患者预后较好,部分患者甚至可达到临床治愈;而晚期或侵袭性强的肿瘤预后相对较差。以下是影响预后的关键因素及不同分期的预后评估。
分子标志物与基因变异
BRCA1/2、ATM等DNA修复基因突变:对PARP抑制剂敏感,但可能提示更高转移风险。
PTEN缺失、TP53突变:与肿瘤进展和耐药相关,预后较差。
AR-V7(雄激素受体剪切变异体):提示内分泌治疗耐药,生存期缩短。
治疗反应
内分泌治疗敏感度:初始治疗有效者生存期显著延长。
多西他赛/新型内分泌药物(如阿比特龙)的应答:影响晚期患者的生存获益。
患者自身因素
年龄与合并症:年轻、体能状态好的患者更耐受强化治疗,预后更优。
骨健康与代谢管理:骨质疏松、糖尿病等合并症可能间接影响生存。
1. 局限性前列腺癌
预后极佳:根治性手术或放疗后,多数患者可长期无复发。
复发风险:低危患者,10年复发率<10%; 高危患者,10年复发率可达30%-50%。
2. 局部进展期(T3-T4/N0)
复发风险高:5年内生化复发率约40%-60%。
治疗策略影响预后:联合放疗+内分泌治疗可降低复发率,延长生存。
3. 转移性前列腺癌(M1)
中位生存期:
传统治疗(仅ADT):2-3年;
新型联合治疗(ADT+多西他赛/阿比特龙):延长至4-6年;
寡转移患者:局部治疗(如转移灶放疗)可能延长生存至5年以上。
转移部位差异:
仅骨转移:预后优于内脏转移;
肝/肺转移:生存期通常较短(中位2-3年)。
早诊早治
高危人群筛查:50岁以上男性定期PSA检测,家族史者提前至45岁。
精准活检:多参数MRI引导靶向穿刺,减少漏诊高危癌。
分层治疗
低危患者:主动监测,避免过度治疗。
高危患者:强化治疗(如手术+放疗+ADT),降低转移风险。
晚期患者综合管理
序贯治疗:内分泌治疗→化疗→靶向治疗(如PARP抑制剂、PSMA疗法)。
症状控制:骨转移患者使用镭-223或双膦酸盐,减少骨相关事件。
生活方式干预
饮食与运动:低脂高纤维饮食、规律锻炼,改善代谢状态。
心理支持:缓解焦虑抑郁,提升治疗依从性。
通过科学预防、规范治疗和全面护理,前列腺癌的预后可显著改善。早期发现是关键,高危人群应定期筛查,患者需积极配合治疗并保持乐观心态。
1、降低可控风险因素
健康饮食:减少红肉、高脂乳制品摄入,增加蔬菜(如番茄、西兰花)和水果(富含抗氧化剂)。适量补充富含番茄红素(如番茄制品)、硒(如坚果)和维生素D的食物。
控制体重:肥胖与前列腺癌风险升高相关,BMI建议控制在18.5-24.9。
适度运动:每周至少150分钟中等强度运动(如快走、游泳),可降低风险。
2、避免环境与激素影响
减少接触致癌化学物质(如镉、农药)。避免长期滥用雄激素类药物(需遵医嘱)。
3、关注遗传与家族史
一级亲属(父亲、兄弟)患前列腺癌者,风险增加2-3倍,建议提前筛查。BRCA1/2基因突变携带者需加强监测。
4、早期筛查与监测
50岁以上男性,或45岁以上有家族史者,需要定期进行以下检查。
PSA检测(前列腺特异性抗原):需结合医生评估,避免过度诊断。
直肠指检(DRE):辅助发现异常结节。
1、治疗期间的护理
【术后护理(如前列腺切除术)】
尿失禁管理:术后早期普遍存在,可通过盆底肌训练(凯格尔运动)改善,严重者需使用尿垫或手术修复。
性功能障碍:神经损伤可能导致勃起障碍,可遵医嘱使用药物(如PDE5抑制剂)或器械辅助治疗。
伤口护理:保持清洁,预防感染,避免久坐压迫。
【放疗期间护理】
泌尿系统保护:多喝水稀释尿液,缓解放射性膀胱炎(尿频、尿痛)。
肠道保护:腹泻或直肠刺激常见,建议低纤维饮食,必要时用止泻药。
【激素治疗护理】
应对潮热:穿宽松衣物,避免辛辣食物,必要时药物干预。
预防骨质疏松:补钙(1000-1200mg/天)和维生素D(600-800IU/天),定期骨密度检测。
2、症状管理与生活质量提升
排尿困难:晚期患者可能出现尿道压迫,可留置导尿管或使用α受体阻滞剂。
骨转移疼痛:按阶梯使用止痛药(如非甾体药→弱阿片类→强阿片类),结合放疗或双膦酸盐治疗。
3、营养支持
高蛋白饮食(鱼肉、豆类)维持肌肉量,避免营养不良。
化疗期间可少量多餐,缓解恶心,必要时使用营养补充剂。
4、心理与社会支持
鼓励加入患者互助小组,缓解对性功能丧失或疾病进展的焦虑。家属需给予情感支持,必要时寻求心理咨询。
5、长期随访
定期复查PSA(术后每3-6个月一次)、影像学检查(骨扫描、MRI)。监测复发或转移迹象,如骨痛、PSA持续升高。
1、增加蔬果摄入:
建议多食非淀粉类蔬菜,如西兰花、卷心菜、花椰菜、菠菜、生菜、甘蓝、羽衣甘蓝、白菜、 蘑菇、芦笋、西葫芦、青椒、番茄等。水果如浆果、苹果、梨、猕猴桃、橙子等。
2、适量摄入优质蛋白质
3、控制脂肪摄入
4、选择健康脂肪
1、限制高脂肪食物
2、避免高糖食物
3、避免辛辣刺激性食物
4、避免壮阳食物
1、泥鳅鱼炖豆腐
【材料】活泥鳅鱼、鲜豆腐、盐、姜、味精各适量。
【做法】将泥鳅鱼剖开,去鳃及内脏,洗净,放入炖盅内,加入食盐、生姜、清水,先用武火烧开后,再用文火清炖至五成熟,加入豆腐块,继续炖至泥鳅鱼肉熟烂,加味料即可。
2、白玉兰猪瘦肉汤
【材料】鲜白玉兰、鲜猪瘦肉。
【做法】将猪瘦肉血污洗净,切成块状,与白玉兰同放入沙锅内,加适量清水,用中火煲汤,汤成后以食盐少许调味,饮汤食肉。
3、栗子炖乌鸡
【材料】乌鸡、栗子仁、海马、盐、姜。
【做法】将乌鸡去肠杂、毛,切块,与栗子仁、海马及盐、姜同放锅内,加水适量蒸熟,分2-3次吃完。
4、萝卜浸蜜
【材料】萝卜、蜂蜜。
【做法】将萝卜洗净,去皮切片,用蜂蜜浸泡,放在瓦上焙干,再浸再焙,连焙3次,每次嚼服数片,盐水送服,每日4-5次。
5、绿豆粱米粥
【材料】车前子、橘皮、通草、绿豆、高粱米。
【做法】将车前子、橘皮、通草纱布包,煮汁去渣,入绿豆和高粱米煮粥,空腹服,连服数日。
6、车前草糖水
【材料】车前草、竹叶心、生甘草、黄片糖。
【做法】将车前草、竹叶心、生甘草同放进砂锅内,加适量清水,用中火煮水,煮40分钟左右,加入黄糖,稍煮片刻即可,每天代茶饮用。
备注:更多食疗方见肿瘤药膳专栏,或点击本页相关文章栏目相应文章链接阅读。